En las células rojas es crucial la presencia del
2,3-bisfosfoglicerato, ya que éste determina la afinidad de la
hemoglobina con el dioxígeno. Para que la hemoglobina funcione
eficientemente, el estado T debe permanecer estable hasta que la unión
de suficientes dioxígenos permita la transición al estado R. El estado T
es muy inestable; esto desplaza el equilibrio hacia el estado R. Esto
resultaría en una baja liberación de dioxígeno en los tejidos. Por lo
tanto es necesario un mecanismo adicional para estabilizar el estado T.
Este mecanismo se descubrió a partir de la comparación de la afinidad
con el dioxígeno de la hemoglobina en un estado puro y en las células
rojas. Se encontró que en un estado puro la hemoglobina se enlaza
fuertemente al dioxígeno, dificultando su liberación, mientras que en
las células rojas su afinidad es menor. Esta diferencia se debe a la
presencia del 2,3-bifosfoglicerato (2,3-BPG). Este compuesto está
presente en las células rojas de la sangre a una concentración igual a
la concentración de hemoglobina (~ 2 mM).
El 2,3-BPG se enlaza al centro del tetrámero, en un ‘bolsillo’ que solo está presente en el estado T. En la transición de T a R, este ‘bolsillo’ colapsa y se libera el 2,3-BPG. Para que esto suceda los enlaces entre la hemoglobina y el 2,3-BPG se deben romper, y a su vez cuando este compuesto está presente se necesitan mayores enlaces de dioxígeno con la hemoglobina, para que ésta cambie su forma de T a R. Por lo tanto la hemoglobina se mantiene en su estado T de baja afinidad hasta que alcance un medio con altas concentraciones de dioxígeno. Debido a esto se le llama al compuesto 2,3-BPG efector alostérico. La regulación por parte de una molécula estructuralmente diferente al O2 es posible gracias al enlace del efector alostérico en un sitio completamente distinto a los sitios de enlace del dioxígeno en la hemoglobina.
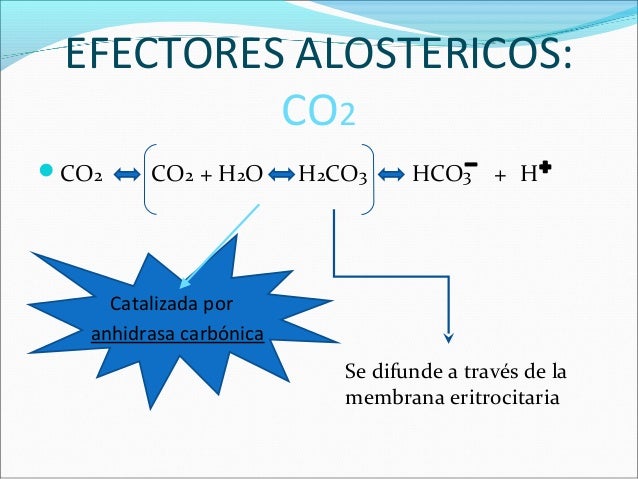
El 2,3-BPG se enlaza al centro del tetrámero, en un ‘bolsillo’ que solo está presente en el estado T. En la transición de T a R, este ‘bolsillo’ colapsa y se libera el 2,3-BPG. Para que esto suceda los enlaces entre la hemoglobina y el 2,3-BPG se deben romper, y a su vez cuando este compuesto está presente se necesitan mayores enlaces de dioxígeno con la hemoglobina, para que ésta cambie su forma de T a R. Por lo tanto la hemoglobina se mantiene en su estado T de baja afinidad hasta que alcance un medio con altas concentraciones de dioxígeno. Debido a esto se le llama al compuesto 2,3-BPG efector alostérico. La regulación por parte de una molécula estructuralmente diferente al O2 es posible gracias al enlace del efector alostérico en un sitio completamente distinto a los sitios de enlace del dioxígeno en la hemoglobina.

Comentarios
Publicar un comentario